食物為生命提供必需的營養物質🌐,是細胞生長🦸🏻♂️🤘🏼、發育、存活的關鍵。食物與免疫系統聯系緊密。長期饑餓導致營養不良🏢,會削弱免疫細胞的反應和執行能力🛤,破壞黏膜屏障,使機體更易遭受病原侵襲👩🏽。有趣的是,優質🐦⬛、足量的飲食對免疫系統同樣弊大於利。工業化進程使得食物能夠持續供應,但肥胖症👸🏼🏚、免疫力低下、自身免疫疾病的發病率反而居高不下🤹🏽。最新的研究表明,間歇禁食或短期饑餓有助於優化免疫系統、提高免疫力👳🏻、降低疾病風險。然而🤶🏼,這種調控是高等動物在進化過程中獨立獲得的🍞,還是代表了所有動物共同的生存策略,目前尚不清楚🏢😓。
自然界中,野生動物的食物完全依賴覓食獲得👷🏽🐾,並隨季節變化而波動,使得饑餓司空見慣。魚類🚶🏻➡️、兩棲類、爬行類等動物甚至進化出強大的耐受饑餓的能力。同時,它們也會主動減少攝食以應對病原感染或環境突變🍸。低等脊椎動物的這些行為,為了解通過飲食幹預優化免疫這一生存策略的進化,提供了理想模型🛤。
近日,顺盈娱乐生命科學學院楊嘉龍團隊在國際權威期刊 Cellular and Molecular Life Sciences 上發表了題為“Dietary restriction to optimize T cell immunity is an ancient survival strategy conserved in vertebrate evolution”的研究論文🧑🏼🦲🔱,揭示了饑餓雙向調控魚類T細胞免疫的分子機製。

Cellular and Molecular Life Sciences 刊發楊嘉龍團隊研究成果
研究人員發現,T細胞是羅非魚免疫系統響應饑餓的主要應答者🦛。長期饑餓導致脾臟萎縮、T細胞凋亡和自發炎症,損傷了免疫細胞穩態,使魚類更容易遭受細菌感染。相反,短期饑餓可在不影響免疫細胞穩態的前提下🙅🏼♂️,提高T細胞應對抗原的激活和分化能力,增強抗感染免疫🧺。
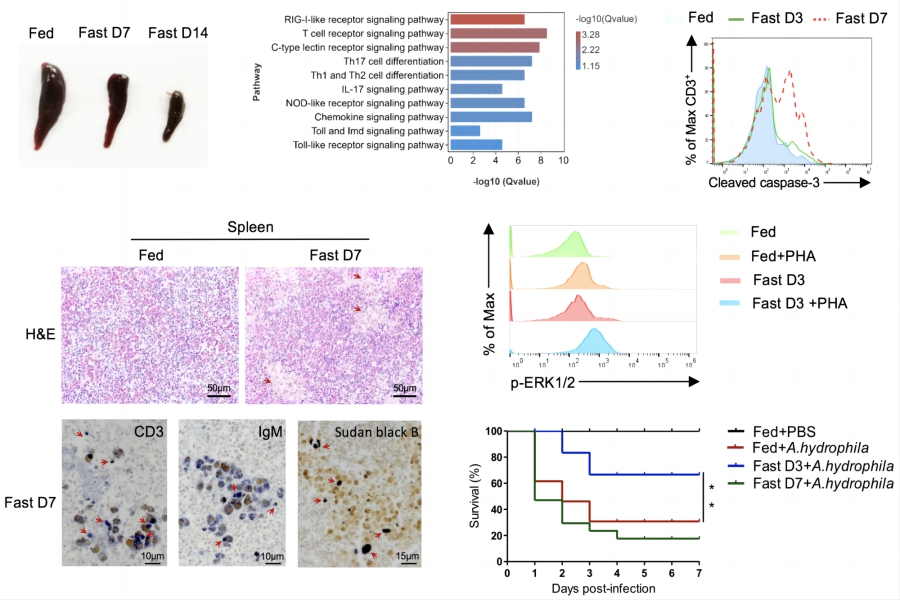
圖1. 饑餓雙向調控魚類T細胞免疫圖
在機製上,饑餓誘發了T細胞自噬。而抑製自噬🪳,則損傷了T細胞的激活🕑、增殖和免疫功能。隨著饑餓時間的延長,T細胞自噬加劇👳🏽♀️;長期饑餓觸發強烈自噬🦹🏻♀️,導致T細胞凋亡🙎♂️,破壞免疫細胞穩態👸🏽。進一步的研究表明,饑餓通過生物能量樞紐AMPK通路介導T細胞的自噬🪖🧒。阻斷AMPK通路🍏,不僅降低了T細胞的自噬水平,造成免疫功能障礙🧜🏼♂️,更損傷了T細胞在能量限製情況下維持存活的能力。實際上,細菌感染同樣能夠引發羅非魚T細胞的自噬;而在短期饑餓的狀態下遭遇感染,能夠將自噬窗口提前📔,加快T細胞的應答速度,增強抗感染免疫能力,減少T細胞的凋亡,並降低組織損傷🤹🏻♀️。
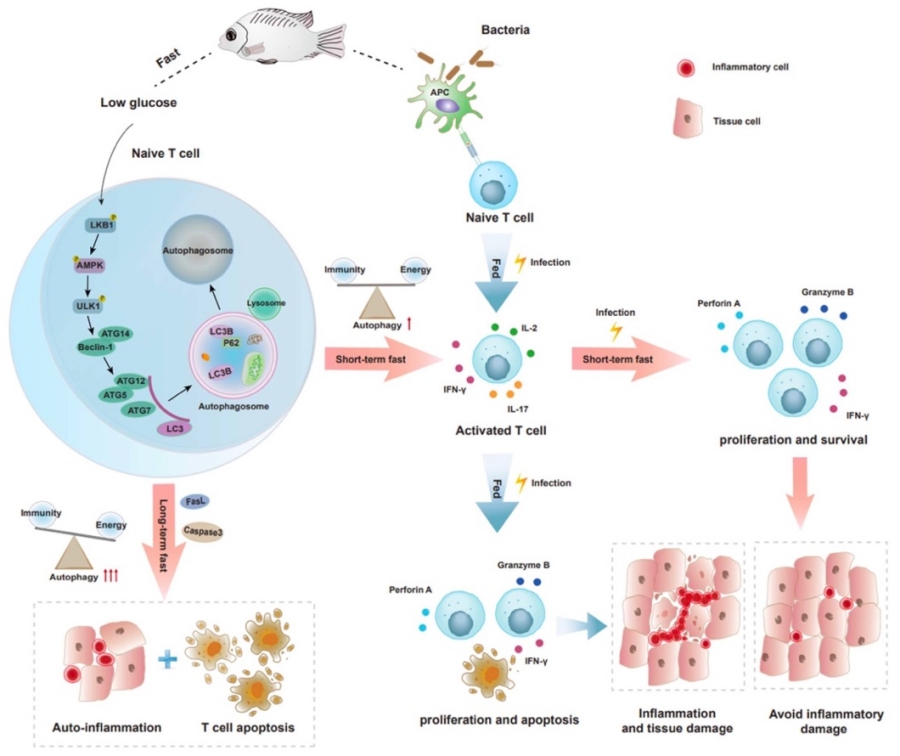
圖2. 饑餓決定魚類T細胞免疫的分子機製圖
綜上所述🤤,本研究闡明了饑餓雙向決定魚類T細胞穩態和免疫的機製。在食物充足、病原感染的情況下,魚類主動停止攝食,通過短期饑餓觸發輕度自噬,增強T細胞免疫,維持免疫和能量平衡,體現了免疫優先的原則。而在食物匱乏的情況下,長期饑餓迫使魚類啟動強烈自噬來回收能量,免疫系統也被犧牲,從而在最大程度上保障生命延續,體現了生存優先的原則🛌🏼。T細胞免疫與能量的權衡,代表了脊椎動物在長期的適應性進化中應對饑餓的生存策略🤶🏿。
生命科學學院李坤明博士、韋秀梅副教授🚵、李康博士生為該論文的共同第一作者🤳🏻,楊嘉龍教授為本文通訊作者。該研究受到國家自然科學基金優秀青年科學基金項目📒、面上項目等資助👪。

楊嘉龍教授(左)、李坤明博士(右)
附:
論文鏈接:https://link.springer.com/article/10.1007/s00018-023-04865-x
來源|生命科學學院、科技處 編輯|史佳妮 編審|郭文君